<!--StartFragment -->
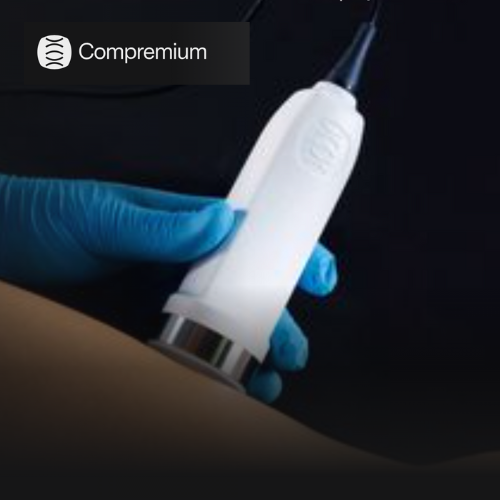
(CONNECT) Compremium et des chercheurs de l'Hôpital de l'Île de Berne lancent la première étude clinique chez l'homme sur un instrument de diagnostic non invasif du cancer de la thyroïde de Compremium. Selon un communiqué de Compremium, l'étude sur l'instrument CPMX2 permettra de déterminer si la compressibilité des tissus, qui distingue les nodules thyroïdiens malins et rigides des nodules bénins et moins rigides, peut faciliter les diagnostics cliniques.
Les participants à l'étude sont jusqu'à 30 patients adultes atteints de nodules thyroïdiens Bethesda IV, qui présentent un risque de cancer de 25 à 40 pour cent. L'opération des nodules est déjà planifiée chez ces patients ; dans le cadre de l'étude, ils seront en outre soumis à une mesure de la compressibilité avec le système CPMX2 au cours des 18 prochains mois.
"Les patients présentant un risque de cancer moyennement élevé sont actuellement souvent opérés à titre préventif, car une biopsie à l'aiguille fine ne confirme ou n'exclut pas suffisamment la malignité. Rétrospectivement, les opérations s'avèrent souvent inutiles. La nouvelle technologie nous aide donc à prendre des décisions cliniques plus précises", explique Urs Borner, responsable de l'étude, cité dans le communiqué. L'instrument d'étude CPMX2 de Compremium permet de visualiser la pression en temps réel, de mesurer avec précision la rigidité des tissus et pourrait réduire le nombre d'opérations actuellement nécessaires pour établir un diagnostic.
L'étude est menée par Borner ainsi que Marco Caversaccion et Samuel Tschopp en collaboration avec Roman Trepp (endocrinologie) et Reto Kaderli (chirurgie viscérale) de l'Hôpital de l'Île de Berne.Compremium est un fabricant de dispositifs médicaux spécialisé dans le diagnostic non invasif des maladies liées à la pression. La technologie CPMX2 de la société, qui combine l'imagerie par ultrasons et les capteurs de pression, a été validée dans plus de 40 études cliniques et utilisée dans plus de 30 indications médicales, indique la société. L'instrument a reçu l'approbation 510(k) de la Food and Drug Administration (FDA) aux États-Unis en 2023. D'autres demandes d'homologation FDA et CE sont prévues pour 2025. ce/ja
<!--EndFragment -->